산업
R&D 선두주자 한미약품 롤론티스, FDA 승인...3조 시장 진출
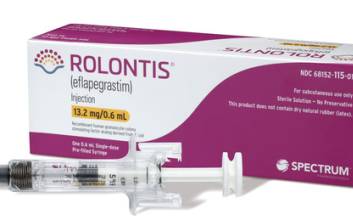
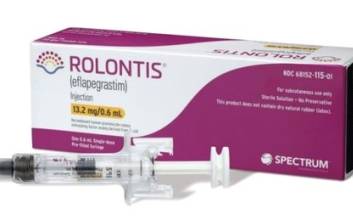
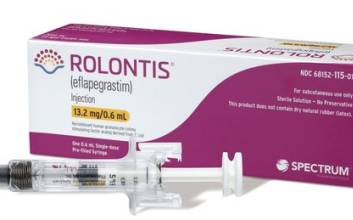
한미약품의 바이오의약품 신약 ‘롤론티스’가 미국 시장에 진출한다. K바이오 연구개발(R&D)의 선두주자 역할을 했던 한미약품의 첫 글로벌 신약 성과다. 한미약품은 파트너사인 미 바이오업체 스펙트럼이 9일(현지시간) 미 식품의약국(FDA)으로부터 호중구 감소증 치료제 롤론티스의 품목허가를 획득했다고 10일 밝혔다. 롤론티스의 이번 FDA 허가는 한미약품이 개발한 신약 중 첫 사례다. 항암 분야 신약으로는 국내 최초, 국내 제약사에서 개발한 신약 중에서는 여섯 번째 FDA 허가 사례다. FDA 실사를 통과한 국내 공장인 한미약품 평택 바이오플랜트에서 생산하고, FDA 허가를 받아 미국 시장으로 진출하는 바이오 신약이기도 하다. 롤론티스는 항암 치료 등으로 인해 백혈구 내 호중구가 비정상적으로 감소한 암 환자에 쓰는 호중구 감소증 치료제다. 국내에서는 지난해 3월 식품의약품안전처로부터 국산 신약 33호로 허가받았다. 체내 바이오의약품의 약효 지속시간을 늘려주는 한미약품의 플랫폼 기술 '랩스커버리'가 적용됐다. 한미약품이 2012년 스펙트럼에 기술을 이전한 뒤 공동 개발해왔고, 이번 허가로 10년 만에 현지에서 상용화가 가능해졌다. 스펙트럼은 2018년 말 미국 FDA에 롤론티스의 품목허가를 처음 신청한 후 자진 취하와 자료 보완, 재신청, 생산시설 실사 등의 절차를 거친 끝에 허가를 따냈다. 품목허가 심사를 받는 기간이 코로나19 대유행과 겹치면서 일부 일정이 지연되는 등 어려움이 적지 않았다. 스펙트럼은 올해 3월 미국 FDA에 롤론티스의 품목허가를 재신청했고, 미국 FDA는 지난 6월 롤론티스의 원액 생산을 담당하는 한미약품의 평택 바이오플랜트 실사를 진행해 별다른 지적 없이 마무리했다. 허가에 따라 현지 영업과 마케팅·판매는 스펙트럼이 맡는다. 스펙트럼은 연내 최대한 신속히 미국 시장에 제품을 출시할 계획이다. 미국의 호중구 감소증 치료제 시장 규모는 약 3조원에 달하는 것으로 알려졌다. 권세창 한미약품 대표이사는 “한미약품 신약 중 첫 FDA 허가 사례이자 독자적 플랫폼 기술인 '랩스커버리'의 상용화 가능성을 입증했다는 데 큰 의미가 있다. 랩스커버리 기반 바이오 신약의 미래 가치를 상승하는 계기가 될 것으로 기대한다”고 말했다. 김두용 기자 k2young@edaily.co.kr
2022.09.10 16:00












![[포토] 나빌레라, 화려한 엔딩](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000232.400x280.0.jpg)
![[포토] 나빌레라, 우아하게 날아오르는 나비들](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000231.400x280.0.jpg)
![[포토] 나빌레라 릴라, 치명적인 엔딩 포즈](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000230.400x280.0.jpg)
![[포토] 나빌레라 릴라, 치명적인 분위기](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000229.400x280.0.jpg)
![[포토] 나빌레라 애니, 우아한 나비 무브먼트](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000228.400x280.0.jpg)
![[포토] 나빌레라 사야, 귀여운 똑단발](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000227.400x280.0.jpg)
![[포토] 나빌레라, 멋진 나비들](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000226.400x280.0.jpg)
![[포토] 나빌레라, 뛰어~](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000225.400x280.0.jpg)
![[포토] 나빌레라, 신나는 '노리미트' 무대](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000224.400x280.0.jpg)
![[포토] 나빌레라, 우아한 나비들](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000223.400x280.0.jpg)
![[포토] 나빌레라, 군무 착착](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000222.400x280.0.jpg)
![[포토] 나빌레라, 쿵짝쿵짝](https://image.isplus.com/data/isp/image/2026/02/03/isp20260203000218.400x280.0.jpg)
