실시간 뉴스
- 20점 차 뒤집은 대역전극…‘나이트 영웅 등극’ 소노, 한국가스공사 꺾고 홈 7연패 탈출 [IS 고양]
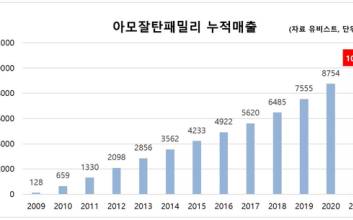
- 마침내 1000조 돌파, 한국 세계 6번째로 7000억 달러 수출 기록
- 쓸쓸한 새해, 이렇게 찬바람 맞을 줄은...FA 미계약 5인의 운명은
- “오늘(1일) 생일인데”…‘의식불명’ 안성기, 응원 봇물…첫째子도 급거 귀국 [왓IS]
- [공식발표] 서울E, 베테랑 공격수 김현 영입 “목표는 우승과 승격”
- ‘까칠 청년 농부’ 안효섭X’불도저 쇼호스트’ 채원빈, 이 조합 찬성 (오늘도 매진)
- “나는 고장 났다” 권민아, 극단적 선택→구조 후 첫 심경 고백 [왓IS]
- ‘무릎 꺾였다’→멀쩡한 신인류 “다음 경기에 돌아올 거”
- ‘스프링 피버’ 이주빈, 동료 교사들 사이 소문만 무성해진 사연
- KIA 8위를 누가 예상했나...FA 최대어·슈퍼 베테랑 이적→2026시즌 경쟁도 '안갯속'
검색결과8건
















![[포토] 정소민, 파격적인 드레스 뒤태](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000268.400x280.0.jpg)
![[포토] 정소민, 우아한 걸음걸이로 퇴장](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000266.400x280.0.jpg)
![[포토] 정소민, 아름다움에 홀릭](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000267.400x280.0.jpg)
![[포토] 김지훈, 카리스마 눈빛](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000264.400x280.0.jpg)
![[포토] 김지훈, 걸음걸이도 완벽한 테리우스](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000263.400x280.0.jpg)
![[포토] 김지훈, 턱시도 핏이 이렇게 잘 어울릴 일?](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000265.400x280.0.jpg)
![[포토] 정소민, 아름다운 순백의 여신](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000262.400x280.0.jpg)
![[포토] 정소민, 여신의 걸음걸이](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000260.400x280.0.jpg)
![[포토] 전여빈, 러블리한 볼하트](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000257.400x280.0.jpg)
![[포토] 정소민, 우아함 종결자](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000261.400x280.0.jpg)
![[포토] 전여빈, 우아한 블랙 드레스](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000259.400x280.0.jpg)
![[포토] 윤계상, 완벽한 슈트핏](https://image.isplus.com/data/isp/image/2025/12/31/isp20251231000258.400x280.0.jpg)
