산업
HK이노엔 곽달원, 비만치료제 과감한 '중국 베팅' 정말 괜찮나
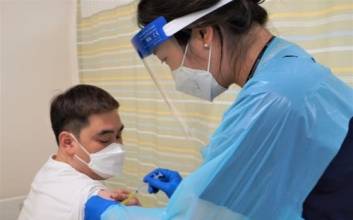
글로벌 시장에서 비만치료제가 급성장세를 보이면서 곽달원 HK이노엔 대표의 ‘중국 베팅’에 대한 관심도도 높아지고 있다. 최근 국내 바이오 기업이 추진한 미국 식품의약국(FDA) 승인이 중국의 바이오 기업으로 인해 발목이 잡히면서 HK이노엔의 선택에 물음표가 붙고 있다. 24일 제약바이오 업계에 따르면 비만치료제가 국내 업체들로부터 각광을 받고 있다. 특히 글로벌 시장에서는 3세대 비만치료제라 할 수 있는 글루카곤 유사 펩타이드-1(GLP-1) 계열의 신약이 인기를 끌고 있다. 노보 노디스크의 ‘위고비’와 일라이 릴리의 ‘젭바운드’가 이 같은 기전의 신약으로 시장을 키우고 있는데, 수요 폭증으로 아직까지 국내에 도입조차 못하고 있다.이 같은 분위기에서 HK이노엔은 지난달 중국의 바이오 기업 사이윈드 바이오사이언스와 비만치료제 신약 라이선스 계약을 체결했다. 이에 HK이노엔은 GLP-1 유사체인 ‘에크노글루타이드 ’의 국내 독점 개발 및 상업화 권리를 확보하게 됐다. GLP-1은 음식을 섭취했을 때 장에서 분비되는 인크레틴 호르몬으로 혈당 조절에 중요한 인슐린 분비를 강력하게 촉진하는 것으로 알려졌다. GLP-1 유사체는 GLP-1과 유사하게 작용하는 약물을 뜻한다.곽달원 대표는 위식도역류질환 신약인 케이캡처럼 비만치료제도 HK이노엔의 대표 제품으로 키우겠다는 복안이다. 빠른 시장 진입을 위해 HK이노엔은 자체 개발이 아닌 임상 중인 물질 도입을 택했다. HK이노엔은 “회사에서 오랫동안 공을 들여 차기 케이캡 후보를 물색했고, 높은 성장세를 보이고 있는 비만치료제를 선택했다”고 설명했다. HK이노엔이 도입한 에크노글루타이드는 주 1회 투여 방식의 주사제로 중국에서 제2형 당뇨 및 비만 임상 3상이 진행 중이다. HK이노엔은 국내에서 제2형 당뇨 및 비만 임상 3상을 동시에 추진할 예정이고, 연내 임상시험계획을 신청할 계획이다. 국내에서 GLP-1 계열의 비만치료제 임상은 한미약품이 3상을 진행하고 있어 가장 빠르다. 만약 HK이노엔이 임상 3상에 들어간다면 신약 승인을 받는다는 전제 하에 시기상으로 두 번째로 비만치료제를 확보할 수 있을 것으로 보인다. 하지만 중국 바이오 기업의 국내 신뢰도가 높지 않다는 측면에서 성공 가능성에 대한 의문부호가 달리고 있다. 지난달 HLB의 간암 신약 리보세라닙이 파트너사인 중국 항서제약의 이슈로 FDA 승인이 불발되자 이런 의구심은 더욱 커지고 있다. 항서제약은 FDA로부터 보완 요구 서한을 받았고, 품질 관리 부분에 대해 지적을 받았다. 업계 관계자는 “항서제약은 중국 1위 제약기업으로 볼 수 있는데 이번 HLB 승인 불발 사태로 인해 중국 제약바이오기업의 신뢰도가 떨어진 측면이 있다”고 꼬집었다. 다른 업계 관계자는 “중국의 바이오 기업들이 세계에서 가장 많은 글로벌 임상을 진행 중”이라며 “그렇지만 국내에서 승인된 중국 회사의 신약은 없다”고 지적했다. 여기에 중국 제약바이오 산업은 미중 갈등 격화로 빨간불이 켜진 상황이다. 미국은 중국 바이오 기업과 거래를 금지하는 생물보안법을 발의한 상황이다. HK이노엔 관계자는 “비만치료제 물질을 도입할 때 중국뿐 아니라 호주 등 다른 지역에서 임상 한 결과가 있었고, 그 효과와 안정성을 확인했다”고 설명했다. 국내의 비만치료제 시장은 2022년 1700억원에서 2030년 약 7200억원 규모로 성장할 것으로 전망된다. 곽달원 대표는 “사이윈드와 긴밀히 협력해 에크노글루타이드를 국내 비만치료 시장에서 1000억원 이상 성과를 내는 제품으로 개발할 것"이라고 강조했다.김두용 기자 k2young@edaily.co.kr
2024.06.25 07:00





















![[포토] 영케이, 귀여운 손인사](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000212.400x280.0.jpg)
![[포토] SBS 가요대전 3MC들](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000213.400x280.0.jpg)
![[포토] 엔시티 드림, 백마 탄 왕자님들 여기 다 모였네](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000209.400x280.0.jpg)
![[포토] 엔시티 드림 마크, 귀엽게 팔 흔들](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000211.400x280.0.jpg)
![[포토] 아이브 장원영, 눈맞춤에 심쿵](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000207.400x280.0.jpg)
![[포토] 아이브 장원영, 럭키비키 워킹](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000206.400x280.0.jpg)
![[포토] 아이브, 산타걸들](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000208.400x280.0.jpg)
![[포토] 아이브 안유진, 아름다운 드레스 자태](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000205.400x280.0.jpg)
![[포토] 스트레이 키즈, 멋진 무대 기대해 주세요](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000204.400x280.0.jpg)
![[포토] 스트레이 키즈 필릭스, 왕자님 비주얼](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000200.400x280.0.jpg)
![[포토] 스트레이 키즈 현진, 시크한 손인사](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000203.400x280.0.jpg)
![[포토] 에이티즈 산, 멋진 손인사](https://image.isplus.com/data/isp/image/2025/12/25/isp20251225000201.400x280.0.jpg)
