산업
식약처, UAE와 바이오헬스 분야 MUO 체결… K바이오헬스 중동진출 새 전환점 맞아
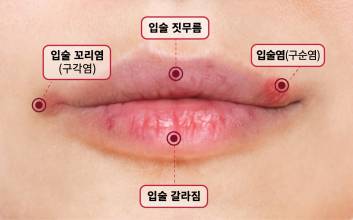
식품의약품안전처(식약처)가 아랍에미리트(UAE) 의료제품 규제기관(EDE)과 바이오헬스 분야 포괄적 협력에 관한 양해각서(MOU)를 18일(현지시간) 체결했다.식약처에 따르면 이번 양해각서 체결은 이달 열린 오유경 식약처장과 사이드 빈 무바락 알 하제리 UAE EDE의 이사회 의장 간 양자회의의 후속 조치다.양국은 양해각서에 따라 바이오헬스 분야의 포괄적·전략적 협력체계를 구축하고, 양국의 의약품, 의료기기, 화장품 등 교역을 활성화하기 위한 상호 협력을 강화한다.양해각서의 주요 내용은 바이오헬스 분야의 ▲공동 세미나·워크숍·교육 프로그램 개최 ▲규제정보·과학 데이터·모범사례 등 정보 교환 ▲전문가 교류 장려 ▲규제혁신, 디지털 전환, 및 안전 관련 공동연구 추진 ▲신기술 공동 협력 프로젝트 개발 지원 등이다. 양국은 구체적 이행을 위해 공동 워킹그룹과 고위급·기관장 회의 등 협력체계를 구축하기로 했다.특히 인공지능(AI)·바이오 등 혁신기술과 주력 수출 품목인 화장품 분야 협력을 강화하기로 한 것은 양국 정상이 합의한 첨단 산업 분야 전략적 협력을 구체화하는 의미가 있다.UAE는 중동 최대의 화장품 수출국으로, K뷰티 열풍 확산에 따라 한국 화장품의 UAE 수출이 최근 3년간 가파른 증가세를 보이고 있다. 이번 양해각서를 통해 화장품 분야에 대한 협력체계를 구축한 것은 중요한 성과다.오유경 식약처장은 UAE EDE의 파티마 알 카비 총괄책임자를 만나 AI·첨단 바이오 분야 관심을 공유하고, 양국의 바이오헬스 발전 및 UAE 내 한국 의료제품의 신속 허가를 위한 세부적인 협력 방안을 논의했다.또 아부다비 줄기세포센터(ADSCC)를 방문해 옌드리 벤투라 CEO와 양국의 첨단바이오 연구기술 분야 전망과 성과를 공유하는 간담회와 UAE의 세포유전자치료제 연구개발 현장을 참관했다.오 처장은 보건산업진흥원 UAE 지사를 방문해 의료제품·화장품 분야 중동지역 수출 현황 및 우리 기업들의 애로사항 등 의견을 청취하고, 식의약 수출 이슈가 발생하는 경우 긴밀히 협력하고 신속 대응할 수 있는 체계를 구축하기로 했다.한편 식약처는 이번 양해각서 체결을 계기로 바이오헬스 규제시스템과 글로벌 진출 지원 시스템을 혁신하고 국제적 위상을 강화해 우수한 K의료제품·화장품의 활발한 해외 진출을 적극 지원할 계획이다.이현아 기자 lalalast@edaily.co.kr
2025.11.20 12:07













![세입자 낀 매물 ‘퇴로’ 열린다…정부, 양도세 중과 유예 종료 보완[only 이데일리]](https://image.edaily.co.kr/images/Photo/files/NP/S/2026/02/PS26020300714B.jpg)
![술 인기 없다더니, 1500만여명 다녀간 마오타이 앱[중국나라]](https://image.edaily.co.kr/images/Photo/files/NP/S/2026/02/PS26020300689T.jpg)




![[포토]채수빈, 호기심 발동!](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000212.400x280.0.jpg)
![[포토]채수빈, 작은 얼굴에 '도대체 몇등신이야?"](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000211.400x280.0.jpg)
![[포토]채수빈, 미소로 주위를 밝히는 마법 시전](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000207.400x280.0.jpg)
![[포토]채수빈, 수줍은 미소](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000206.400x280.0.jpg)
![[포토]채수빈, 눈빛만으로 '분위기 여신'](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000204.400x280.0.jpg)
![[포토]채수빈, 현실감 떨어지는 비율](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000203.400x280.0.jpg)
![[포토]채수빈, 청순함 가득 담아 '하트'](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000202.400x280.0.jpg)
![[포토]채수빈, 오늘은 하트 요정](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000201.400x280.0.jpg)
![[포토]채수빈, 하트 더하기 애교](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000200.400x280.0.jpg)
![[포토]채수빈, 팬들 선물에 함박미소](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000199.400x280.0.jpg)
![[포토]채수빈, 청순 하트](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000198.400x280.0.jpg)
![[포토]이주빈, 날씨만큼 화사한 출국길](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000182.400x280.0.jpg)
