실시간 뉴스
- [2026 밀라노] '심석희 밀고 최민정 추월' 하나가 된 女 계주, 오명 지운 황대헌(종합)
- ‘김연아를 넘어서는 스타다’→日 매체도 최가온 금메달에 주목…“영화의 주인공 같다” [2026 밀라노]
- 아이유도 인정, ‘성발라’ 저력…‘설 특집 콘서트 성시경’ 예능 시청률 1위
- ‘판사 이한영’ 지성 “많은 사랑 감사, 정의 향한 여정 오래 남길” 종영 소감
- 우주소녀, 단아한 한복 자태…”붉은 말의 해, 원하는 일 모두 이루시길”
- '김하성 낙마→진짜 주전 됐다' 대표팀 유격수 김주원, "혜성이 형과 눈빛만 봐도 알 수 있도록.." [IS 인천공항]
- 장윤정 “1년간 행사로 주유비로 2억 5천만원” (백반기행)
- “린샤오쥔, 비참하게 탈락”→中 매체 조명…황대헌은 1500m 은메달 [2026 밀라노]
- [영상] '반전소녀' 빈예서, “잔소리보단 용돈 두 배!”… 설맞이 밸런스 게임 인터뷰
- ‘판사 이한영’ 지성, 박희순에 복수 성공…금토드라마 왕좌 1위 지켰다 ‘유종의 미’
X
가장 많이 본 뉴스
경제
글로벌 제약사, '속도보다 안정성 초점' 코로나 백신 공동 선언문 준비
등록2020.09.06 12:37
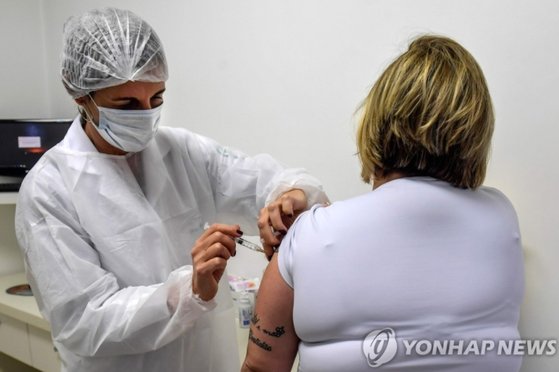
백신이 안전하고 효과적이라는 게 입증되기 전까지는 정부 승인을 받지 않겠다는 게 골자다. 미국 월스트리트저널(WSJ)은 5일(한국시간) 화이자, 존슨앤드존슨, 모더나를 포함한 제약사들이 이 같은 서약이 담긴 공동 선언문을 준비 중이라고 보도했다. 이들 제약사는 서약에서 안전과 백신을 접종한 사람들의 건강을 최우선으로 삼고, 백신의 임상 시험과 제조 공정에서 과학적 윤리적 기준을 높게 적용키로 했다.
WSJ는 서약이 이르면 내주 초 공개될 예정이라고 복수의 관계자를 인용해 전했다. 이번 보도는 도널드 트럼프 미국 대통령이 11월 대선을 앞두고 백신 개발을 너무 성급하게 추진한다는 우려가 이는 가운데 나온 것이다. 트럼프 대통령은 4일 백악관 기자회견에서도 "올해 안에 코로나19 백신이 나올 것으로 전망된다"며 "11월 1일 이전에, 10월에 나올 수도 있을 것으로 본다"고 말했다.코로나19 백신 배포를 담당할 질병통제예방센터(CDC)도 오는 11월 코로나19 백신 접종이 가능할 것이라고 지난주 발표했다. FDA가 주재하는 코로나19 백신 외부 전문가 회의 역시 오는 10월 말 예정돼 있다.
이를 두고 일각에서는 정부가 도널드 트럼프 대통령의 재선을 위해 대선일인 11월3일 이전 백신 접종을 서두르려는 것 아니냐는 우려를 제기하고 있다.기업들이 준비 중인 서약서 초안에는 미 식품의약국(FDA) 지침에 따른 코로나19 백신의 3상 임상 시험에서 안전과 효과 면에서 충분한 검증이 이뤄진 뒤에 정부에 긴급 승인을 요구하도록 하는 내용이 담겼다. 백신 개발의 최종 단계인 3상 임상 시험에서 접종군의 증상 발현율이 비접종군과 비교해 낮다는 게 입증돼야 한다.
이들 백신은 앞으로 수개월 내에 잠정 결과가 나올 것으로 예상되며, 정부의 긴급 사용 허가를 받거나 승인을 받을 가능성이 있다.FDA는 코로나19 백신이 위약과 비교해 50% 이상의 효과성이 입증되지 않을 경우 허가하지 않는다는 방침을 세웠다.
김두용 기자 kim.duyong@joongang.co.kr
당신이 좋아할 만한정보
AD
당신이 좋아할 만한뉴스
지금 뜨고 있는뉴스
행사&비즈니스
많이 본뉴스















![[포토] SMTR25, 나란히 횡단보도 건너기](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000154.400x280.0.jpg)
![[포토] 승한, 멋진 분위기](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000153.400x280.0.jpg)
![[포토] 라이즈 원빈, 가만히 서 있어도 화보](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000152.400x280.0.jpg)
![[포토] 라이즈 원빈, 빛이 나네](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000151.400x280.0.jpg)
![[포토] 에스파 카리나, 에?](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000147.400x280.0.jpg)
![[포토] 에스파 카리나, 요정 그 자체](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000146.400x280.0.jpg)
![[포토] 에스파 지젤, 당당한 횡단보도 런웨이](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000148.400x280.0.jpg)
![[포토] 에스파 닝닝, 물오른 미모](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000145.400x280.0.jpg)
![[포토] 에스파, 우리의 거리는 이정도야...](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000149.400x280.0.jpg)
![[포토] 에스파 윈터, 사랑스러운 분위기](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000144.400x280.0.jpg)
![[포토] 에스파 닝닝, 걸어오는 모습도 아름다워](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000143.400x280.0.jpg)
![[포토] 엑소 수호, 엄지척](https://image.isplus.com/data/isp/image/2026/02/13/isp20260213000142.400x280.0.jpg)