연예
코로나 백신 개발 어디까지…"이례적 개발 속도, 올 연말 나올 가능성 높아"
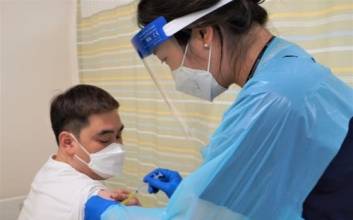
전 세계적으로 코로나19가 재확산되고 있는 가운데 각국에서 나오는 백신 개발 소식에 시민들이 웃다, 울다를 반복하고 있다. 12일 러시아에서 모스크바 세체노프 의대 산하 약품임상연구센터가 임상 1상 시험에서 백신의 안정성이 확인했다는 소식이 날아들었다. 하지만 같은 날 프랑스 정부 자문위원으로 활동하는 감염병 전문가 아르노 퐁타네 교수는 100% 효과적인 백신이 내년까지 개발될 가능성은 희박하다며 찬물을 끼얹었다. 과연 코로나19 백신은 나올 수 있을까. 국내외에서 진행되고 있는 백신 개발은 어디까지 와있을까. 국내에서 백신 개발 임상시험 단계에 들어간 곳은 2곳이다. 국제백신연구소와 바이오 기업 제넥신이 임상 1상을 진행 중이다. 서유석 제넥신 전무는 일간스포츠와 전화 인터뷰에서 “지금 팬데믹 상황에서 백신이 아니면 해결이 안 될 것 같다”고 말했다. 제넥신은 6월 말 임상을 시작했고, 소용량 1차 투입을 마친 뒤 중용량 투입에 들어갔다. 'GX-19'라는 자체 개발한 물질로 임상을 진행하고 있고, DNA 백신 유형이다. 국내 백신 개발은 아직 초기 단계이지만, 영국 옥스퍼드대와 아스트라제네카가 공동으로 개발하고 있는 백신은 임상 3상이 진행 중이다. 중국 시노백이 개발 중인 백신도 브라질에서 임상 3상에 들어갔다. 대규모로 이뤄지는 임상 3상이 마지막 단계라 볼 수 있기 때문에 이르면 올해 말 백신이 나올 가능성이 높다. 서 전무는 “한국의 진행 상황은 옥스퍼드대, 시노백과 비교하면 6개월 정도 늦은 셈이다. 다른 국가에서 올해 말 코로나 백신이 나오는 게 가능할 것 같다”라고 말했다. 국제백신연구소 제롬 김 사무총장도 올 연말 백신 출시를 예측하고 있다. 김 사무총장은 “세계적으로 17개의 백신 후보물질이 임상에 들어갔고, 전례 없는 빠른 속도로 진행되고 있다. 바이러스 종식을 위해 국제백신연구소도 연구개발을 적극적으로 지원하고 있다”고 말했다. 영부인 김정숙 여사가 국제백신연구소의 한국후원회 4대 명예회장을 맡고 있기도 하다. 세계보건기구(WHO)가 내년 말까지 필요하다고 밝힌 백신의 양은 20억 도즈다. 전 세계적으로 200여 종의 백신 후보물질 연구가 이뤄지고 있고, 무려 181억 달러(약 21조7000억원)를 투입해 백신 개발을 적극적으로 지원한다는 계획이다. 한국 정부도 코로나19 국산 치료제·백신 개발 등을 위해 추가 경정 예산 1936억원을 투입한다. 구체적인 집행계획을 보면 백신의 임상시험 지원에 490억원을 책정했다. 14일 한국제약바이오협회에서 진행될 코로나 치료제 백신 개발 지원대책 설명회에서 기업들에 대한 구체적인 지원책이 공개될 예정이다. 해외에서 먼저 출시된다고 하더라도 ‘백신 자주권’을 위해 백신 개발은 지속할 전망이다. 서 전무는 “백신이 개발되는 회사의 자국민 접종이 우선일 수밖에 없다. 또 전 세계적으로 50억명분이 필요하기 때문에 한국에서도 개발돼야 한다”고 말했다. 그는 “제넥신도 내년 말 출시를 목표로 준비하고 있다. 가격, 안정성, 편리성을 충족시킬 수 있는 백신이 나와야 모두가 효과를 볼 수 있다”고 했다. 백신 개발에 대한 부정적인 시각이 없지 않다. 보통 백신의 개발 기간을 5년으로 잡는다. 만약 올해 백신이 나온다면 1년 만에 출시되는 셈이다. 서 전무는 “백신이 이렇게 빨리 나온 적이 없다. 그래서 효과와 안정성 부문에서 충분한 결과가 안 나오면 지연될 여지가 있다”고 말했다. 백신은 건강한 사람들이 접종해도 부작용이 없어야 하는 등 안정성에 더욱 초점을 맞추고 있어 개발 소요 기간이 치료제보다 더 길 수밖에 없다. 또 임상 규모가 크기 때문에 개발 비용이 더 많이 들어간다. 여기에 코로나19는 변이가 쉬워서 백신 개발이 더욱 까다롭다. 변이가 쉬운 에이즈(후천성면역결핍증)의 경우는 아직까지 백신이 개발되지 못했다. 김두용 기자 kim.duyong@joongang.co.kr
2020.07.14 07:00




















![[포토] NCT 드림 지성, 으 추워라~~](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000164.400x280.0.jpg)
![[포토] NCT 드림 지성, 귀여운 볼빵빵 손인사](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000165.400x280.0.jpg)
![[포토] NCT 드림 지성, 남친룩의 정석](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000166.400x280.0.jpg)
![[포토] NCT 드림 지성, '밥 먹었어?'](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000163.400x280.0.jpg)
![[포토] NCT 드림 지성, 귀여운 곰돌이 인형 가방에 달고](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000162.400x280.0.jpg)
![[포토] 스트레이 키즈 현진, 얼굴로 심장 공격](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000155.400x280.0.jpg)
![[포토] 스트레이 키즈 현진, 데님 패션이 찰떡이야](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000157.400x280.0.jpg)
![[포토] 스트레이 키즈 현진, 냉동고 추위 대한에도 패션 포기 못해](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000158.400x280.0.jpg)
![[포토] 스트레이 키즈 현진, 섹시한 남자](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000154.400x280.0.jpg)
![[포토] 스트레이 키즈 현진, 영화 속 한 장면](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000156.400x280.0.jpg)
![[포토] 에이티즈 성화, 잘생겨서 줌인](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000153.400x280.0.jpg)
![[포토] 에이티즈 성화, 귀여운 토끼 귀 포즈](https://image.isplus.com/data/isp/image/2026/01/20/isp20260120000152.400x280.0.jpg)
