실시간 뉴스
- 기성용, '성폭행 의혹 제기' 후배 상대 손배소 내달 시작
- 줄라이칼럼, ‘2026 FW 서울패션위크’서 한국 건축 구조 재해석한 새 컬렉션 발표
- 산시성 메이현 타이바이산, 겨울 관광지로 주목, 온천·설경 관광객 증가
- 정철원, '가정폭력' 주장 아내 김지연 입장문 무대응..."아이 위해, 더는 이슈화 바라지 않는다" [IS 타이난]
- ‘하시4’ 변호사 이주미, 법무법인 퇴사했다 “완전한 백수” [IS하이컷]
- 그래미 무대 선 캣츠아이 라네즈 글로벌 앰버서더 됐다
- 2000만원 삭감? 윤동희 "납득할 수 있는 결과...선수 가치는 구단이 판단" [IS 타이난]
- KG에코솔루션, 울산 바이오선박유 공장 증설 완료… 연 3만6000톤 공급 체제 구축
- 이런 외국인 선수가, NC 홈런왕 선수단에 '데이비슨 캐릭터 티셔츠' 선물
- "상무 가기 전에 불사르겠다고" 몸도 마음도 벌크업, 삼성 육선엽 "목표는 팀 우승, 다 쏟아붓고 가야죠"
경제
2년 6개월 만에 탄생한 국산신약, 유한양행 렉라자정
등록2021.01.18 16:10
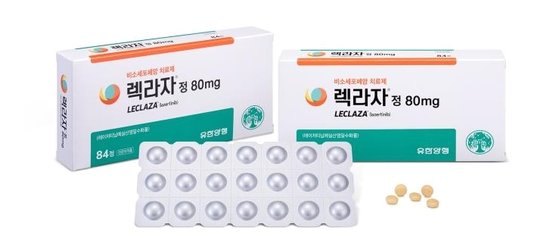
식품의약품안전처는 18일 유한양행의 비소세포폐암치료제 '렉라자정'(성분명 레이저티닙메실산염)을 국내 31번째 개발 신약으로 허가했다고 밝혔다. 2018년 7월 허가 받은 HK이노엔의 위식도 역류질환 치료제 케이캡정 이후 2년 6개월 만에 국산 신약이다.
렉라자정은 특정 유전자(EGFR T790M)에 변이가 있는 진행성 폐암 환자 중 이전에 표적 치료제 'EGFR-TKI'로 폐암치료를 받은 적이 있는 환자에게 사용된다. 이에 따라 1·2세대 EGFR 표적 치료제에 내성이 생긴 환자 치료에도 사용할 수 있게 됐다. 또 렉라자정은 폐암 세포 성장에 관여하는 신호전달을 방해해 폐암세포의 증식과 성장을 억제하는 표적항암제로, 정상 세포에는 독성이 적은 장점이 있는 것으로 전해졌다.
유한양행은 2015년 렉라자정을 전임상 직전 단계에서 도입해 물질 최적화, 공정 개발, 전임상과 임상을 거쳤다. 유한양행은 이번 제품을 치료적 탐색 임상시험인 국내 임상 2상 결과를 토대로 시판 후 치료적 확증 임상시험인 임상 3상을 수행한 것을 조건으로 허가 신청했다.
식약처는 신청 의약품의 품질, 안전성·효과성, 시판 후 안전관리계획을 약사법에 따라 심사했다. 또 의료현장에서 폐암을 치료하고 있는 전문가 등이 포함된 중앙약사심의위원회에서 렉라자정의 허가 완결성과 제도 부합성에 대한 자문을 거쳐 최종 허가했다. 렉라자정 임상 논문의 제1저자인 안명주 삼성서울병원 혈액종양내과 교수는 "이번 허가가 EGFR T790M 돌연변이 양성인 비소세포폐암 환자에게 적합한 치료 옵션이 될 것으로 기대된다"고 말했다.
김두용 기자 kim.duyong@joongang.co.kr
당신이 좋아할 만한정보
AD
당신이 좋아할 만한뉴스
지금 뜨고 있는뉴스
행사&비즈니스
많이 본뉴스

















![[포토]채수빈, 호기심 발동!](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000212.400x280.0.jpg)
![[포토]채수빈, 작은 얼굴에 '도대체 몇등신이야?"](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000211.400x280.0.jpg)
![[포토]채수빈, 미소로 주위를 밝히는 마법 시전](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000207.400x280.0.jpg)
![[포토]채수빈, 수줍은 미소](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000206.400x280.0.jpg)
![[포토]채수빈, 눈빛만으로 '분위기 여신'](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000204.400x280.0.jpg)
![[포토]채수빈, 현실감 떨어지는 비율](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000203.400x280.0.jpg)
![[포토]채수빈, 청순함 가득 담아 '하트'](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000202.400x280.0.jpg)
![[포토]채수빈, 오늘은 하트 요정](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000201.400x280.0.jpg)
![[포토]채수빈, 하트 더하기 애교](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000200.400x280.0.jpg)
![[포토]채수빈, 팬들 선물에 함박미소](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000199.400x280.0.jpg)
![[포토]채수빈, 청순 하트](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000198.400x280.0.jpg)
![[포토]이주빈, 날씨만큼 화사한 출국길](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000182.400x280.0.jpg)