산업
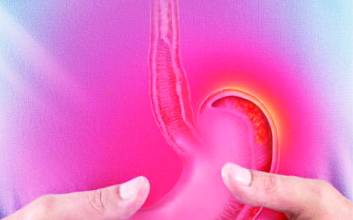
한국콜마 글로벌 시장 성적표의 열쇠 '케이캡', 2028년 연매출 1조 겨냥
HK이노엔이 한국콜마 글로벌 시장 성적표의 결정적 열쇠가 될 전망이다. 윤상현 한국콜마홀딩스 부회장이 역대 최대 규모의 인수자금을 베팅한 이유도 여기에 있다. 16일 업계에 따르면 HK이노엔은 국내 30호 신약인 케이캡을 보유하고 있다. 위식도역류질환 신약인 케이캡은 국내 신약 중 최소 기간 1000억원 매출을 달성하는 등 빠르게 시장을 선점하고 있다. 지난 10일에는 동남아 최대 시장인 인도네시아 출시도 알렸다. 케이캡은 한국을 포함해 중국, 멕시코, 인도네시아 등에 연이어 출시되면서 시장 진출 속도를 높이고 있다. 올해 하반기 중 싱가포르에 출시될 예정이다. 이어 페루, 콜롬비아, 태국, 베트남, 말레이시아 등 허가 심사 중에 있어 해외 진출에 가속도가 붙을 전망이다. 한국콜마가 인수 당시 HK이노엔에 투자한 인수금액은 1조3000억원에 달한다. 국내 제약사 최대규모의 인수합병이다. HK이노엔은 케이캡을 무기로 그 가치를 증명하고 있다. HK이노엔은 2023년 기준으로 미국, 캐나다, 중국, 브라질 등에 1조원 이상의 기술수출에 성공했다. 2028년까지는 유럽 포함 100개국 수출, 연매출 1조원 달성을 목표로 내걸고 있을 만큼 자신감을 드러내고 있다. HK이노엔은 2019년 한국에서 케이캡을 출시했고, 지난해 세계 소화성궤양용제 시장 1위 규모인 중국에도 진출했다. 이어 케이캡은 몽골, 필리핀과 함께 중남미 의약품 시장 규모 2위 국가인 멕시코에도 진입했다. 케이캡은 현재 한국 포함 6개 국가에서 처방되고 있다. 기술수출이나 완제품 수출 형태로는 총 해외 35개 국가에 진출했다. 곽달원 HK이노엔 대표는 "동남아시아 소화성궤양용제 시장은 연평균 약 6%씩 성장하는 고부가가치의 시장"이라며 "동남아시아 최대 시장인 인도네시아에 케이캡을 출시하게 돼 기쁘다"고 말했다.
특히 HK이노엔은 해당 분야 세계 규모 1위인 중국 시장에서 케이캡의 성장을 기대하고 있다. 올해 3월 중국 보험이 적용되면서 본격적인 매출이 발생하기 시작했고, 3분기부터 로열티를 수령할 예정이다. HK이노엔 관계자는 “중국의 31개 성에 대한 등록을 모두 완료했고, 종합병원에도 순차적으로 등록 중”이라며 “연내 종합병원 80% 이상 등록이 목표”라고 밝혔다. 케이캡은 지난해 국내에서만 연간 1300억원이 넘는 원외처방 실적을 기록했다. 올해는 1~5월 국내 누적처방 실적이 607억원이고, 5월에만 130억원을 달성하는 등 계속 성장하고 있다. 신약 중 최단기간 내 매출 1000억원을 달성한 블록버스터가 된 이유는 분명하다. 케이캡만의 강점이 위식도역류질환 치료제의 패러다임 전환을 주도하고 있기 때문이다. 그동안 프로톤 펌프 억제제(PPI) 계열이 주류였지만 케이캡은 칼륨 경쟁적 위산분비 억제제(P-CAB) 계열로 두각을 나타내고 있다. HK이노엔 측은 “케이캡은 빠른 약효 발현, 식전·식후 상관없이 투약이 가능하다는 강점이 있다”며 “기존 PPI계열 제품과 달리 약물 상호작용 우려가 적은 점 등으로 기존 계열의 한계를 극복한 점에서 실제 의료환경에서 좋은 반응을 얻고 있다”고 설명했다. 대웅제약도 국내 34호 신약인 위식도역류질환 치료제 펙수클루의 허가로 시장을 공략하며 케이캡의 경쟁사로 떠오르고 있다. HK이노엔 관계자는 “케이캡은 국내 P-CAB계열 제품 중 가장 많은 5가지 적응증을 보유하고 있고, 모든 적응증이 보험 급여에 적용되는 등 지속적인 연구개발을 통해 경쟁력을 강화하고 있다”며 “신약의 성공을 뒷받침하는 건 데이터인데, 케이캡은 관련 임상 논문 48건으로 압도적으로 많다”고 강조했다. 김두용 기자 k2young@edaily.co.kr
2023.07.17 06:56
















![[마켓인] 바이아웃만으론 부족…글로벌 PE, 사모대출 역량 다지기 박차](https://image.edaily.co.kr/images/Photo/files/NP/S/2026/02/PS26020201731T.jpg)


![[포토]채수빈, 호기심 발동!](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000212.400x280.0.jpg)
![[포토]채수빈, 작은 얼굴에 '도대체 몇등신이야?"](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000211.400x280.0.jpg)
![[포토]채수빈, 미소로 주위를 밝히는 마법 시전](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000207.400x280.0.jpg)
![[포토]채수빈, 수줍은 미소](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000206.400x280.0.jpg)
![[포토]채수빈, 눈빛만으로 '분위기 여신'](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000204.400x280.0.jpg)
![[포토]채수빈, 현실감 떨어지는 비율](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000203.400x280.0.jpg)
![[포토]채수빈, 청순함 가득 담아 '하트'](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000202.400x280.0.jpg)
![[포토]채수빈, 오늘은 하트 요정](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000201.400x280.0.jpg)
![[포토]채수빈, 하트 더하기 애교](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000200.400x280.0.jpg)
![[포토]채수빈, 팬들 선물에 함박미소](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000199.400x280.0.jpg)
![[포토]채수빈, 청순 하트](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000198.400x280.0.jpg)
![[포토]이주빈, 날씨만큼 화사한 출국길](https://image.isplus.com/data/isp/image/2026/02/01/isp20260201000182.400x280.0.jpg)
