산업
동아에스티·메타비아, 비만치료제 임상 1상 결과 '체중 4.3% 감소'
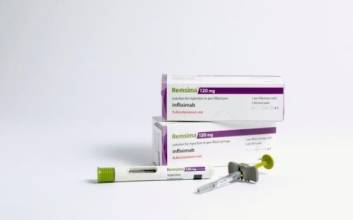
동아에스티와 관계사 메타비아가 개발 중인 비만치료제 임상 1상 결과를 발표했다. 메타비아는 4일(현지시간) 미국 애틀랜타에서 열린 미국비만학회에서 비만치료제로 개발 중인 'DA-1726' 임상 1상 및 전임상 연구에서 체중 감소 효과를 확인한 결과를 포스터 발표했다고 5일 밝혔다.임상 1상은 DA-1726 단일 및 다중 용량에서 안전성, 내약성, 약동학 등을 확인하기 위해 비만 성인 9명을 대상으로 진행됐다.연구 결과에 따르면 DA-1726 투여군은 투약 26일 만에 체중이 최대 6.3%, 평균 4.3% 감소했다. 허리둘레는 최대 3.9인치(10㎝) 감소했으며 투약 종료 후 2주간 효과가 이어졌다.또 용량에 비례하는 약동학 특성을 보였고, 평균 반감기는 80시간으로 나타나 주 1회 투여 가능성을 확인했다는 설명이다. 전임상 연구에서는 고지방 식이 유도 비만(DIO) 쥐 모델을 대상으로 진행한 결과 식욕 억제와 에너지 소비 증가를 통해 체중 감소를 촉진했다는 결과가 제시됐다.최근 비만약으로 쓰이는 성분인 티르제파타이드 대비 비슷한 음식 섭취량에도 우수한 체중 감소를 보였으며 이는 기초대사량이 유의미하게 더 증가했기 때문이라는 설명이다. 비슷한 계열 물질인 펨비두타이드 대비 체중 감소 효과는 비슷하게 나타났다고 덧붙였다.메타비아는 최대 내약 용량(MTD)을 탐색하기 위한 추가 임상 1상을 진행 중으로 올해 말 데이터를 발표할 예정이라고 밝혔다.김형헌 메타비아 대표는 "DA-1726은 차별화된 비만치료제로서 경쟁력을 강화하고 있으며, 현재 진행 중인 최대 내약 용량 탐색을 위한 추가 임상 1상을 통해 경쟁력을 더욱 명확히 입증해 나가겠다"고 말했다.김두용 기자
2025.11.05 15:33
















![“21만전자·106만닉스 땡큐”…반도체 ETF ‘불기둥’[펀드와치]](https://image.edaily.co.kr/images/Photo/files/NP/S/2026/03/PS26030200230T.jpg)





![[포토] 인사말 하는 이승훈](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000133.400x280.0.jpg)
![[포토] 인사말 하는 빠니보틀](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000132.400x280.0.jpg)
![[포토] 인사말 하는 김무열](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000131.400x280.0.jpg)
![[포토] 인사말 하는 비](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000130.400x280.0.jpg)
![[포토] '크레이지 투어', 꼭 본방사수 부탁드려요~](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000129.400x280.0.jpg)
![[포토] '크레이지 투어', 화이팅](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000128.400x280.0.jpg)
![[포토] '크레이지 투어', 기대해도 좋아요](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000125.400x280.0.jpg)
![[포토] '크레이지 투어', 색다른 조합](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000126.400x280.0.jpg)
![[포토] '크레이지 투어', 네 남자의 케미 기대해 주세요](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000127.400x280.0.jpg)
![[포토] '크레이지 투어' 연출한 송가희 PD](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000123.400x280.0.jpg)
![[포토] '크레이지 투어' 연출한 오동인 PD](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000124.400x280.0.jpg)
![[포토] '깡' 포즈 취하는 이승훈, '지훈이 형 보고 있어요?'](https://image.isplus.com/data/isp/image/2026/02/27/isp20260227000118.400x280.0.jpg)
